基因治疗载体AAV衣壳改造的研究进展
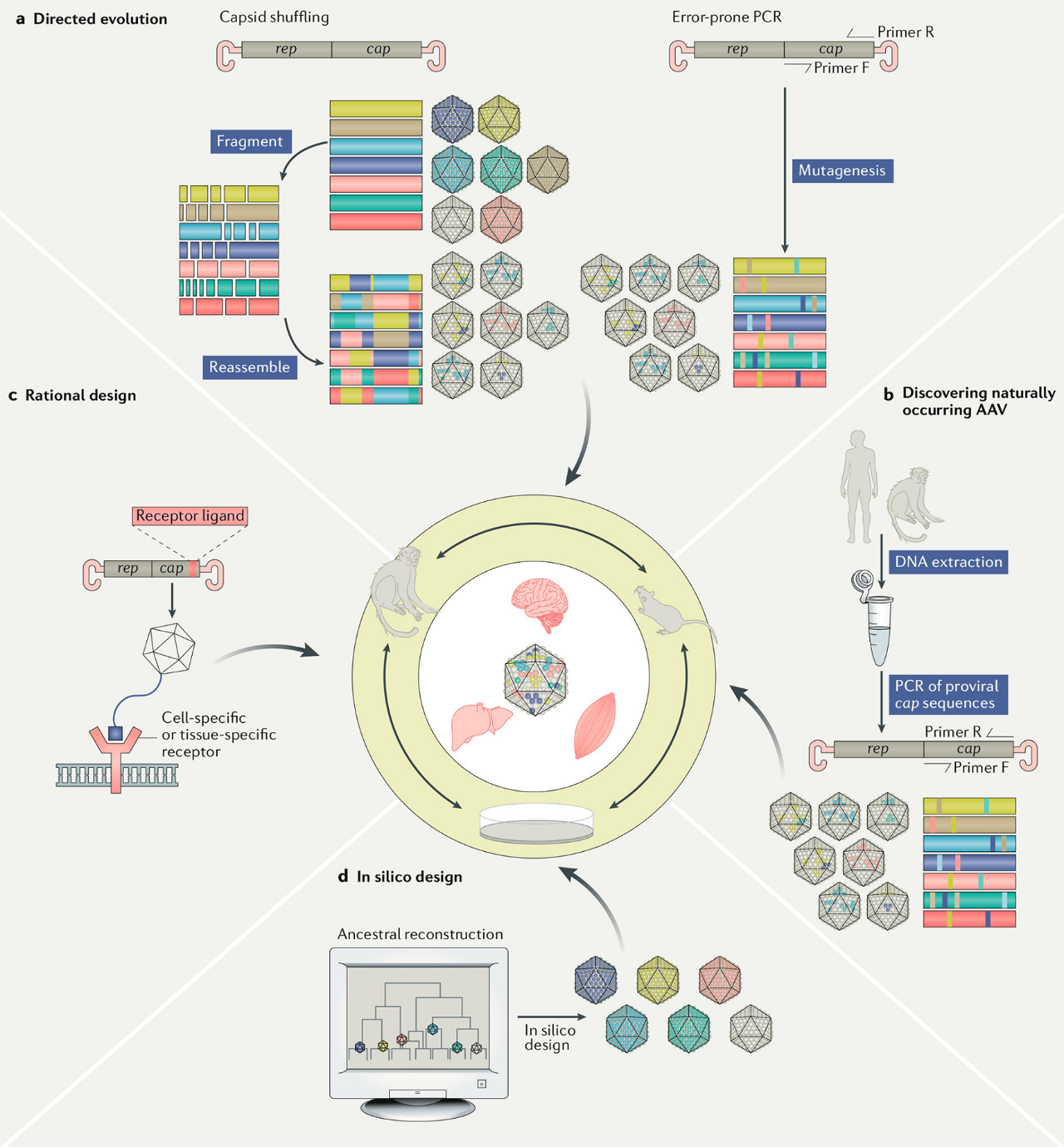
随着高通量测序方法的进步,天然衣壳多样性的发现变得简单。单分子实时 (SMRT) 测序等长读长测序技术允许对全长原病毒基因组进行测序,而无需进行序列重建。由于在个体患者的组织活检样本中观察到多种 AAV 血清型,因此该技术提供了观察由于几个 AAV 基因组之间自然重组而导致的变异的能力。
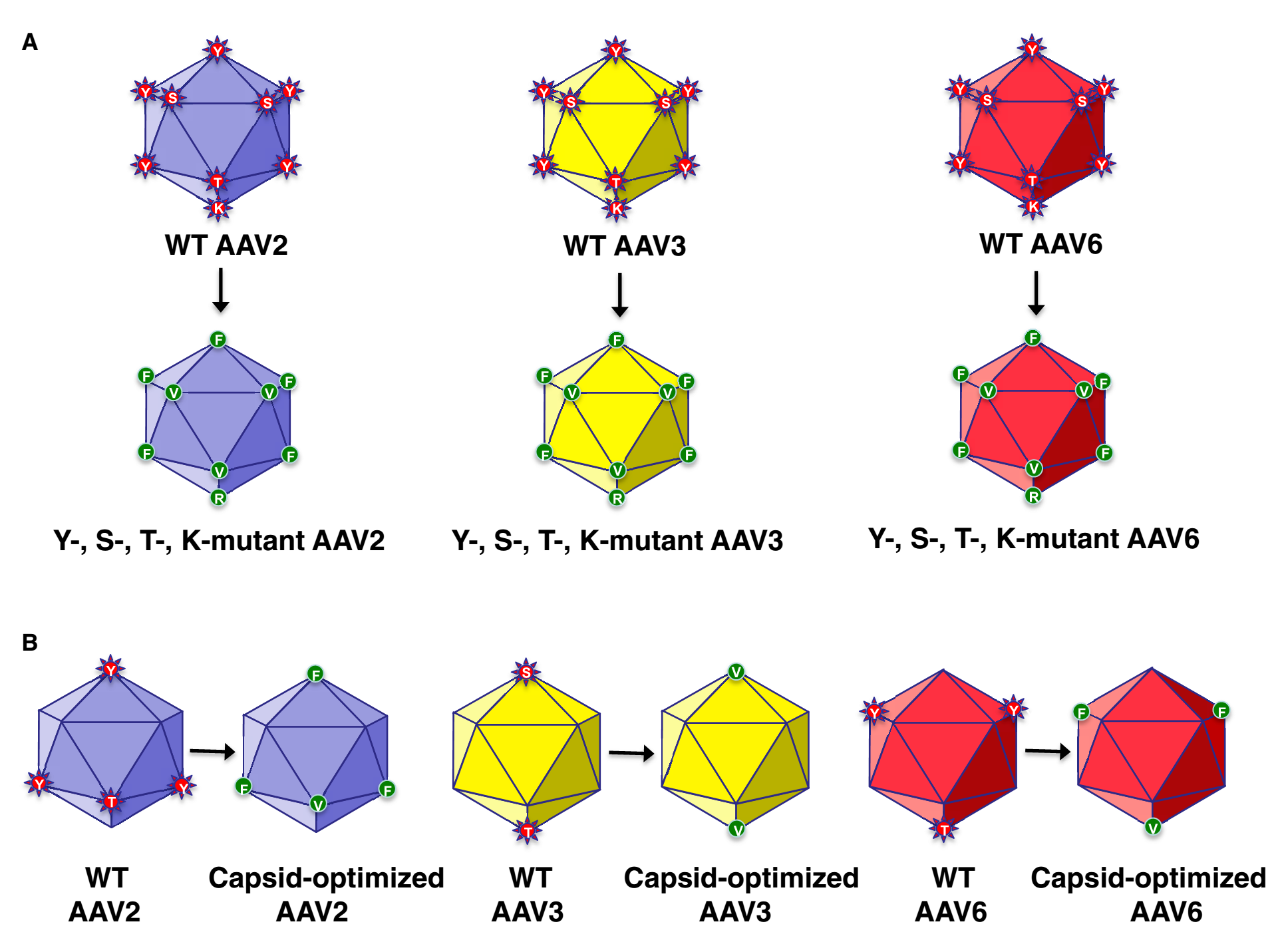
通过合理设计改善载体转导的另一种方法是破坏衣壳的细胞降解。蛋白酶体抑制剂可以在体外和体内增强 AAV 转导,这表明修饰 AAV 衣壳以降低其泛素化可以使 AAV 病毒粒子避免蛋白酶体介导的细胞质降解。事实上,突变 AAV2 衣壳上暴露于表面的酪氨酸残基阻止了其磷酸化、随后的泛素化和蛋白酶体介导的降解。在小鼠肝脏中,这些修饰载体的转导比未修饰的 AAV2 高 10 倍以上。在其他血清型的衣壳上突变暴露于表面的酪氨酸残基也增强了不同动物模型中许多组织或细胞中的 AAV 转导。具有酪氨酸特异性突变的 AAV 血清型正在进入临床治疗,包括眼部疾病基因治疗 (ClinicalTrials.gov NCT02416622)。Luxturna 使用大约 40 年前开发的第一代 AAV2 载体,将这些研究的结果与使用 Luxturna 获得的结果进行比较应该会对后期应用有一定的参考意义。此外,修饰 AAV 衣壳上与泛素化相关的赖氨酸和丝氨酸残基也增强了转导。
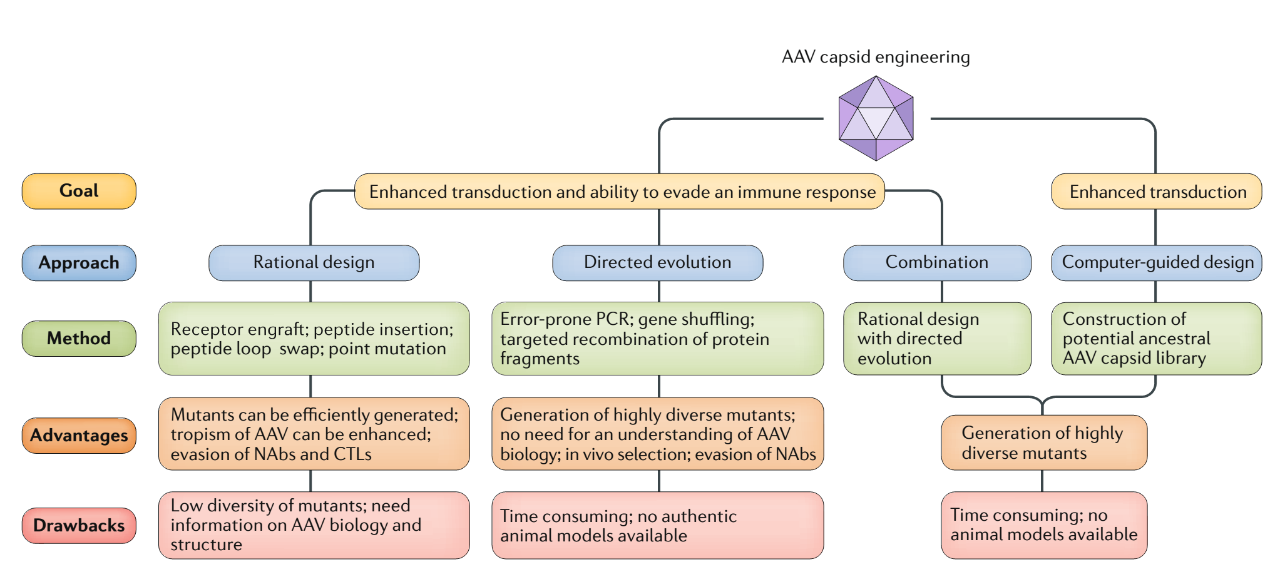
通过合理的设计也可用于生成具有新的转导特性的AAV衣壳,来将基因传递到通常不允许进行 AAV 转导的细胞中。例如,从噬菌体展示库中选择特定的细胞靶向肽并将其掺入 AAV 衣壳中以制造 AAV 突变体。然而,这种方法可能会改变病毒衣壳中肽的构象或阻止肽与靶细胞上的受体有效结合。因此还可以选择从随机 AAV 展示肽库中选择具有靶向性的衣壳变体。编码肽库的随机核酸序列,包括与靶细胞上的特定受体结合的那些,被插入到 AAV 衣壳基因组的允许位点,例如 AAV2 VP1氨基酸的 587 或 588位。源自这些突变体的 AAV 文库用于在 AAV 病毒粒子表面展示靶向肽。感染靶细胞后,AAV 突变体从特定组织或细胞中分离出来并进行表征。这种方法已被用于使用来自不同 AAV 血清型的模板分离对各种组织或细胞特异的 AAV 突变体。除了插入的肽之外,没有在AAV 衣壳中引入额外的突变;因此,使用随机肽库的方法被归类为合理设计。随着靶向肽在药物递送中的使用变得越来越流行,我们可以期待在各种 AAV 血清型的骨架中插入肽的应用会增加。
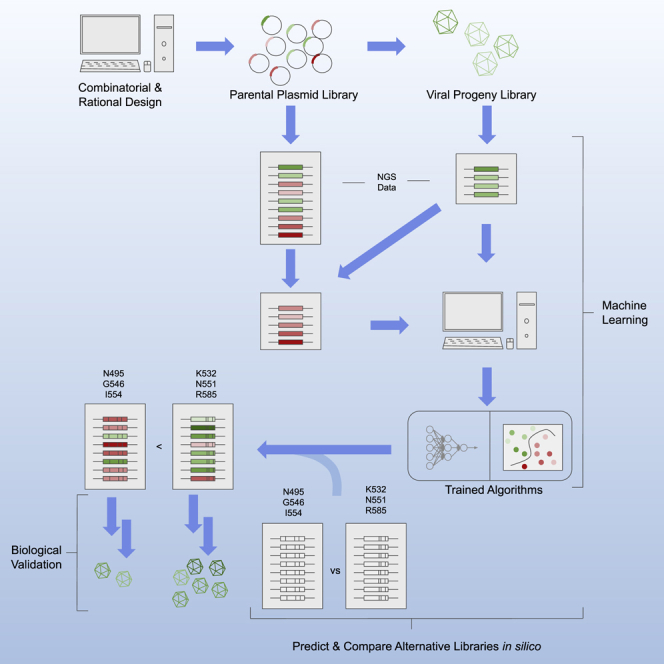
现代实验技术可以分析大量的生物序列,但工程蛋白质文库很少超过天然蛋白质家族的序列多样性。机器学习 (ML) 模型直接在没有生物物理建模的情况下根据实验数据训练,提供了一种获取工程蛋白质的全部潜在多样性的途径。哈佛医学院Eric D. Kelsic团队应用深度学习来设计高度多样化的AAV2衣壳蛋白变体,这些变体对于 DNA 有效载荷的包装仍然可行。专注于 28 个氨基酸的片段,生成了 wtAAV2的201,426 个变体,产生了 110,689 个可行的工程化衣壳,其中 57,348 个超过了天然 AAV 血清型序列的平均多样性。即使在有限数据上进行训练时,深度神经网络模型也能准确预测不同变体的衣壳活力。这种方法解锁了大量功能性但之前无法到达的序列空间,在产生改进的病毒载体和蛋白质疗法方面具有许多潜在的应用。