基因治疗工艺开发“秘籍”:平台CMC如何实现商业化规模生产?
一、如何做好CMC是个大话题BIOB
据了解全球范围内因为CMC问题被延迟审批的占比在80%左右,比例之高令人咋舌,也让行业从业人员愈发重视CMC。
那么如何快速补齐CMC短板,避免在CMC问题上踩坑走错路走弯路呢?吸取了失败经验之后,研究人员发现一般要从下面四点来考虑,分别是基因治疗的工艺开发、分析方法开发、质量控制和申报要求以及CDMO的选择。其中基因治疗工艺开发是最上游的关键点,也是想要将基因治疗药物推向商业化规模生产比较重要的一点。
二、技术与成本双重挑战下的基因治疗工艺开发BIOB
从生产流程来看,基因治疗药物的工艺开发通常包括8个阶段:准备工作、基因构建、细胞培养、生产放大、分离纯化、质检与控制、制剂与包装、储存与运输。其中与CMC控制息息相关的更多的是从基因构建到质检控制,大致可以概括为病毒载体的生产细胞选择及变更、病毒载体的生产上下游工艺的选择、质粒生产的污染及交叉感染风险的控制。
01
病毒载体的生产细胞选择及变更
已上市的基因治疗药物在递送载体层面以病毒载体为主。然而开发病毒载体可放大的经济高效的生产工艺仍挑战重重,其中选择病毒载体的生产细胞对产品质量、安全性和有效性至关重要。选择生产细胞时要考虑多方面因素:病毒载体的类型、病毒载体滴度表达水平(早期开发阶段需要考虑商业化阶段适应症和生产规模问题)、安全性、稳定性(稳定的生产能力)、成本、生产细胞的知识产权授权等。病毒载体的生产细胞选择和临床试验阶段的变更都是重要的环节,需要进行严格的评估和控制,以确保病毒载体的安全性、有效性和质量可控性。
02
病毒载体的生产上下游工艺的选择
以rAAV病毒载体为例,其生产流程纷繁复杂,上游涵盖细胞扩增、病毒包装、收获及深层过滤等关键环节;下游则涉及粗纯、精纯及原液制备等精细步骤。流程如下所示:
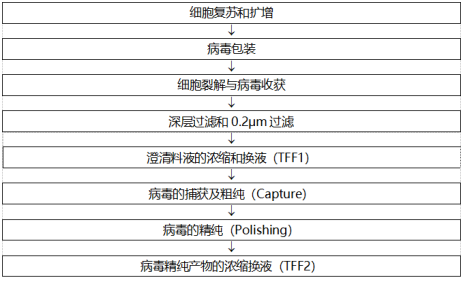
在进行病毒上下游工艺开发及物料选择时应考虑诸多因素,上游和下游生产工艺的选择与开发,与研发,QC和临床等部门高度相关。病毒载体上下游生产工艺也面临诸多挑战,比如工艺放大困难,产量难以满足需求,项目开发周期长,纯化得率低,空壳及部分包装病毒去除,核酸残留等。
其中病毒载体过滤纯化低,就可能与市场上的各种过滤膜材质的选择(板膜,中空纤维和卷膜)、病毒的捕获、粗纯与精纯方式选择(AAV亲和层析填料纯化、离子交换层析纯化)、浓缩换液方式选择(中空纤维柱或者卷膜)等有关。科百特对上下游的整体工艺进行了整体考虑,一直致力于各种微孔过滤膜,纳米纤维和超滤膜的研究和开发,提供创新的过滤纯化解决方案,目前已开发出了十多种独特的核心材料,建立了从滤膜,折叠滤芯,囊式过滤器,超滤膜堆,中空纤维滤芯,除病毒滤芯,一次性储液袋(2D/3D)和搅拌袋、金属过滤器,过滤系统设计和验证测试分析的完整的过滤分离产业链。行诚生物团队则专注在工艺优化,成功开发出独特的无层析质粒工艺。通过理解工艺过程的关键工艺参数,和参数把控实现纯度高,杂质低的目标,不需要额外的步骤去降低在过程中产生的杂质,最终简化了工艺,且质量更优,无层析质粒工艺已服务多家客户,帮助客户大幅降低了生产成本和工艺时间。
03
质粒生产的污染及交叉感染风险的控制
由于质粒的理化特性,在质粒产品生产过程中,污染和交叉污染控制是保证质粒产品质量和安全的关键。由于每个受污染的要素都可能严重危害产品质量,因此消除污染和交叉污染对于质粒生产来说是最重要的,必须建立药品生产的污染控制策略。某公司药物中美双报成功经验分享有提到,他们发现FDA审批特别强调临床前的CMC研究,并且因为发生过一些跟质粒交叉污染相关的安全性事件,所以该公司对于CMC的理解比较深入,最终成功在美国没有经过IIT研究直接申报了IND。
三、严苛的CMC意义何在?BIOB
必经之路
CMC是做药人的必经之路,有好的科学基础和实验室工艺,而没有CMC加持,是很难做到商业化的。不管是中国还是美国,CMC都是基石。监管机构的要求首要是安全,其次是长期的计划性,不能只短期考虑临床,要长远考虑商业化。CMC对整个制药的生命周期都是很重要的。在早期大家可能更关注成药性和生产工艺,不会做特别多特别细致的深入研究就快速的推上临床,这里要有一个平衡,要在早期积累很多数据,做一些打底子的工作,将来再向商业化转化的时候会更快更稳更省。
最大的瓶颈和壁垒
对所有的制药来说,第一步的瓶颈都是CMC,小分子成熟度已经很高了。过往十年生物制药蓬勃发展,大分子药物的CMC会成为最大的瓶颈和壁垒。由于中国的CGT发展还在早期,刚刚部分走到临床,CMC的价值大家还没有领略到,经验还很不足。但我们看到国家审评的标准在逐步提升,行业同仁的意识随着商业化的到来也逐步提高,现在正是补上CMC短板的时候。
IIT产品也要重视CMC
虽然IIT不要求full GMP,但作为制药人要时刻保持敬畏之心,完全创新的产品在做IIT时要严格把控对风险的评估,要有科学的基础和很好的CMC的工艺,否则是对临床的不负责任。如果一开始只为临床,就像盖楼只为盖5层打地基。等要盖到20层时发现地基不行,要拆了重盖就非常不划算了。
为可及性助力、为全球化助力
细胞基因治疗目前几十万上百万美金的价格,在中国是达不到可及性的。可喜的是降成本是有很大空间的。首先,我们学习好的工艺,再借助中国本土原材料供应链如科百特、行诚生物等的优势,把成本降下来。其次,我们要坚持长期主义,在早期打好CMC的地基,为将来的商业化铺平道路,减少不必要的浪费。这样一来,成本就可以大幅度降低,真正把细胞基因治疗药物变成大众药品,就像早年的抗体药一样,惠及更多患者。
目前已有一些药物成功和国际大的药企合作完成license out。未来真正创新的药物也一定是要有全球化的战略。看全球的市场就要考虑CMC的可拓展性,如果CMC的标准达不到全球的标准,势必会导致MNC要评估重做CMC的成本和时间周期。而如果能在初期就考虑到这些问题,也会加速后面的全球化。

