CAR-T细胞自述在人体内的命运
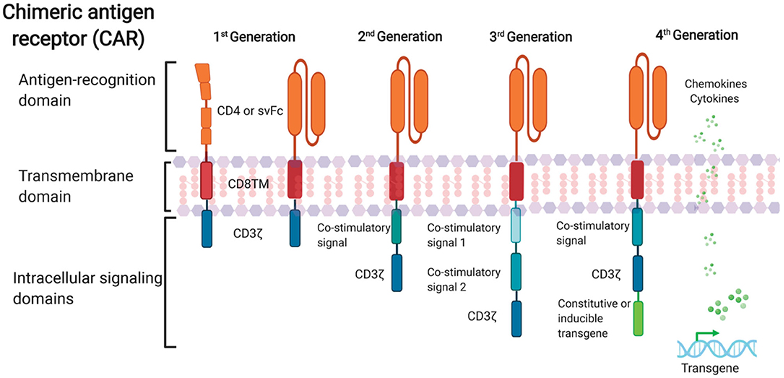
在人体内的命运
我们是改造好的带有“治疗”基因片段的 CAT-T 细胞,与传统药物不同,人们称我们为“活”的药物。我们在进入患者体内后具有增殖能力,显示出独特的细胞动力学特征,传统的药动学参数和药动学模型并不适用于我们。下面我将重点介绍下,当我们进入患者体内后都发生了什么,我们的命运何去何从。
1第一阶段
第一步,我们通过静脉注射进入人体。此刻,我们高度集中在血液循环系统,但在 CAR “小雷达”的帮助下,我们能迅速定向游到肿瘤等组织部位,血液循环中的 CAR-T 细胞数目在短时间内急剧降低。
我们可以通过与选择素、趋化因子和整合素等因子相互作用,成功聚集在肿瘤块中,我们的嵌合抗原受体(CAR)与肿瘤相关抗原特异性结合后,我们细胞内信号转导结构域会产生一系列信号转导级联反应,导致我们被激活,随后诱导我们分泌细胞因子、增殖T细胞和毒性反应等一系列动作,其中,细胞毒性 CD8+ CAR-T 细胞激活后释放的 TNF-α、INF-γ、颗粒酶和穿孔素,可直接杀伤摧毁肿瘤细胞;CD4+ CAR-T 细胞活化后可通过分泌释放的细胞因子激活免疫系统的其他成分来介导促进杀肿瘤效应。
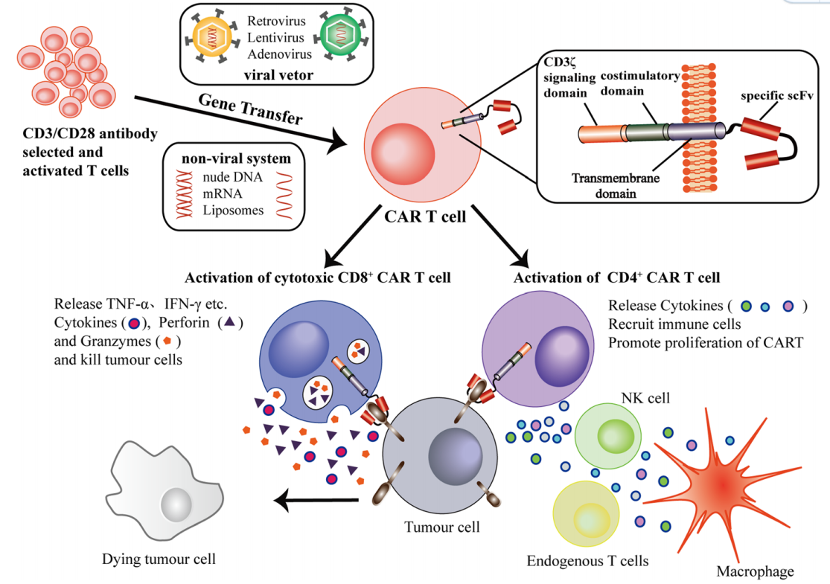
以上第一阶段,通常发生在我们被输注人体后 0-5 天。在此期间,被活化的我们会在肿瘤内持续扩增,我们中的大部分仍保留在肿瘤块内,但也有少部分会再循环到外周血(PB)中。同时,如前所述,活化的我们具有杀肿瘤作用,且释放大量细胞因子,从而引发局部炎症反应。此外,肿瘤浸润巨噬细胞和树突状细胞可能会增强局部炎症。在此期间,临床上可以观察到许多局部炎症表现【3】,此乃正常副作用,不要发慌,但仍要保持监测。
当然,值得一提的是,流散于非肿瘤部位的我们不仅仅是一种资源浪费,而且增加了副作用的严重程度,因此,研究人员会通过不同方式来增强我们归巢分布到肿瘤部位的能力,例如:增强肿瘤组织选择素与整合素等表达来增强我们在肿瘤中的分布;在输注我们之前,消耗外周血中循环的肿瘤细胞来使更多的我们归巢到肿瘤组织部位等。
2第二阶段
第二阶段,我们的局部扩增和分泌的细胞因子开始大量流入血液循环系统。这一阶段通常发生在我们被输注入人体后的 3-12 天。在此阶段的早期,可以在 PB 中观测到我们和炎症因子(例如 IL-6)的快速增加。在接下来的一两周内,PB 中的我们和炎症因子的水平将持续上升,直至达到峰值。通常,最强烈的全身性细胞因子释放综合征就发生在这个阶段。此阶段人类的主要临床表现为顽固性发热、血压下降、肺功能受损、肝功能损害、浆膜腔渗出增多、凝血异常等【4】。值得注意的是,第一阶段和第二阶段在实践中有时会混合,特别是当患者肿瘤块非常大或给药前患者伴有明显炎症时【5】,具体真的因人而异。
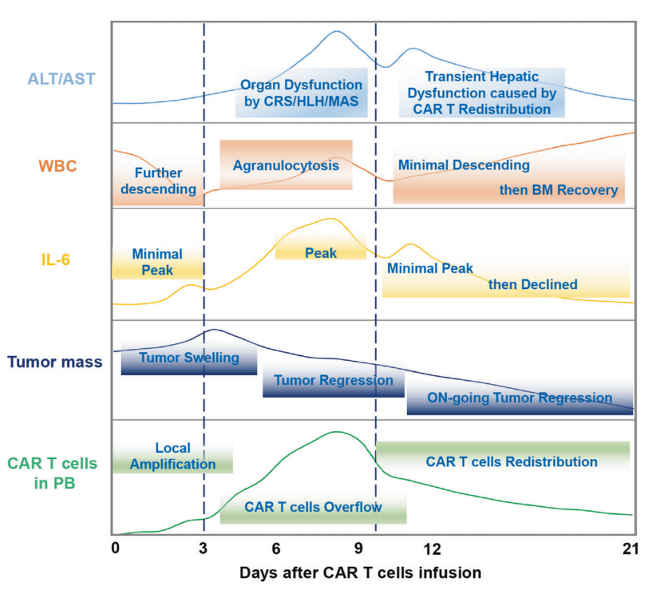
3第三阶段
在第三阶段,由于缺乏肿瘤抗原的刺激,我们的增殖受到影响,可谓失去了“原动力”,这导致PB中我们的数量减少。该阶段通常发生在我们被输注入人体 10-21 天后【7】。在此阶段的早期,还可以观察到PB中白细胞的小幅减少,我们在外周的数量相对快速减少和一些肝损伤【8】。这表明了我们在体内的重新分布,研究发现我们的这种重新分布可能归因于靶细胞的缺失【9】。重新分布的我们可能会激活组织驻留的免疫细胞,如巨噬细胞或中性粒细胞,从而导致器官损伤和其他副作用【10】。
4第四阶段
如果细胞因子释放综合征能够得到有效控制,则进入第四阶段(恢复阶段),此阶段通常在我们被输注人体约 3 周后开始。在此期间,PB 中的我们数量持续下降,炎症因子也恢复到正常水平。肿瘤负荷和骨髓抑制(BMS)逐渐缓解,造血开始恢复,同时外周血白细胞计数逐渐增加。调节性免疫细胞,如骨髓源性抑制细胞(MDSC)和调节性 T 细胞(Tregs)也得到补充,这应该是阻止我们二次扩增的重要因素了【11】。
此外,除上述大部分的我们经历活化诱导走向死亡外,也有小部分的我们将维持数月至数年的记忆细胞表型以产生持久的抗肿瘤活性。CAR-T 细胞疗法的持久性是评估该疗法有效性的关键指标之一,为了提高我们的持久性,研究人员通常对 CAR 结构进行精心设计或其他手段,例如:①据报道,与含 CD28 的 CAR-T 细胞相比,含有 4-1BB 结构域的第二代 CAR-T 细胞持久性更强,更容易分化成 CD8+ 中央型记忆细胞;②去年一篇 Nature Communications 的研究报道发现,长效人源细胞因子 IL-7(NT-I7)与针对 CD19 + B 细胞淋巴瘤和急性髓性白血病的 CAR-T 细胞体内联合给药治疗结果显示,NT-I7 可显著增加 CAR-T 细胞在体内的持久性和扩增能力【12】。

