一文读懂细胞与基因疗法中常用病毒载体
1腺相关病毒载体(AAV Vectors)
AAV 是一种非包膜微小 DNA 病毒,在众多病毒载体中,AAV 载体凭借着较高的安全性与转基因效率,成为了基因治疗领域中的一款明星载体。它的安全级别达到了 RG1(病毒载体最高安全等级),这意味着它的潜在致病性几乎为零【1】。相比之下,腺病毒的安全级别为 RG2,逆转录病毒则为 RG3。一般情况下,AAV 载体基因组几乎不整合到宿主细胞基因组中,而是以附加体的形式游离于宿主染色体之外,因此,在非分裂组织细胞中能够长时间表达目的基因。如果使用极高的多重感染或在存在腺病毒复制酶的情况下感染细胞,则整合的概率或频率可能会增加【2】。除了安全性高,AAV 载体还具有其他优势,例如:能够感染分裂细胞和非分裂细胞、较高的转导效率、特定组织和细胞的靶向性、相对较低的免疫原性等【3】。
鉴于 AAV 在治疗遗传病方面的优势,AAV 基因治疗临床试验在过去几年处于高速增长状态,1998 至 2007 年,公开进行的 AAV 基因治疗临床试验只有 22 项,而在 2018 年至 2022 年 6 月的 4 年半间这一数量翻了数倍,临床试验达到 120 项。这些试验中至少 22 项临床试验已进入临床3期【5】,截止目前,已有多 款基于 AAV 载体的基因治疗药物获批上市,例如:用于治疗脊髓性肌萎缩症(Spinal Muscular Atrophy, SMA)的Zolgensma、用于治疗芳香族 L-氨基酸脱羧酶 (AADC) 缺乏症的 Upstaza、用于治疗血友病 A 的 Roctavian、用于治疗血友病 B 的 Hemgenix 等【6】。
尽管,AAV 载体在基因治疗方面有如上多种优势,但在某些方面也存在一些缺陷,限制了 AAV 在某些方面的应用,例如:
(1)AAV 载体的包装容量不高于 5K【7】,这限制了 AAV 载体在不同疾病治疗方面的更广泛应用,因为有的不少疾病的治疗需要向组织细胞内递送的目的基因片段大于 AAV 载体的容量上限;(2)由于 AAV 介导的转基因几乎不整合进细胞基因组中,所以转基因的细胞比例会随着细胞的分裂而逐渐被稀释或丢失,因此,需要长时间转基因表达且细胞分裂旺盛的组织器官往往不适合采用 AAV 作为转基因载体;(3)因为不少患者对 AAV 有预存免疫反应,这限制了 AAV 载体在患者人群中的更广泛应用。
2腺病毒载体(Ad Vectors)
腺病毒是一种无包膜的双链DNA病毒,其直径为 70 至 90 nm【8】,可容纳 26-45 kb 的线性双链 DNA 基因组。到目前为止,人们已经开发了三代腺病毒载体。第一代腺病毒载体是通过用长度可达 4.5 kb 的转基因盒取代 E1A/E1B 区域而设计的。在第二代腺病毒载体中,通过额外删除 E2/E4 位点进一步增强了基因转导能力,但由于在生产细胞中的复制能力下降,总体产量仍然很低。第三代腺病毒载体,除 ITR 和包装信号外,其所有病毒序列均被剔除。与第一代和第二代腺病毒载体相比,这些病毒载体的免疫毒性大大降低,但仍保持了较高的转导率和嗜性【9】。
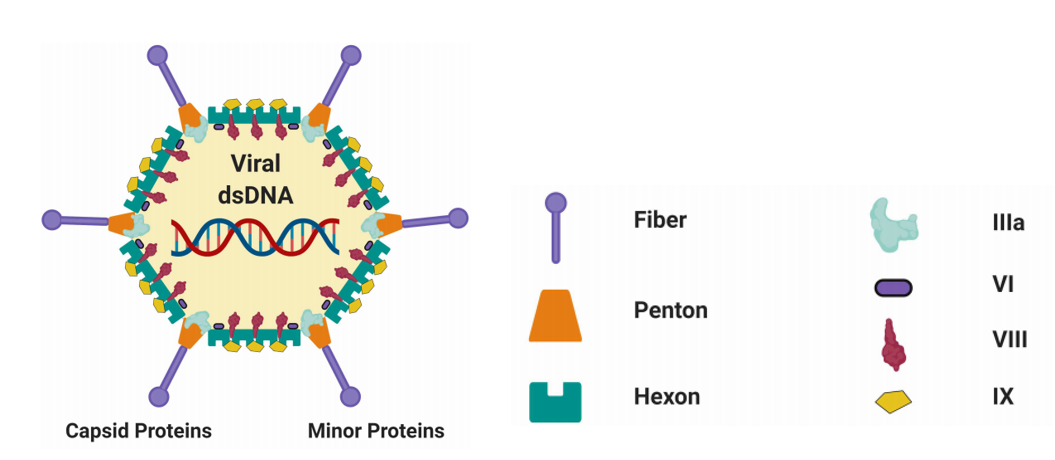
如上所述,腺病毒载体的优势在于其载体容量大,另外,其制备及纯化过程相对简单,且能感染分裂和非分裂细胞,转导基因的效率高,从而让目标细胞获得目的基因的高效表达。研究表明,腺病毒载体是适用于各种细胞和组织类型的有效的基因递送系统。这是因为人类大多数细胞的细胞膜表达有两个必要的受体,即负责腺病毒与细胞粘附接触的柯萨奇腺病毒受体(CAR)和负责将腺病毒内化的整合素型受体【11-13】。腺病毒载体在基因治疗临床应用方向上,可被改造为复制缺陷型腺病毒载体或选择性复制的溶瘤腺病毒。目前,有几款基于腺病毒载体的基因治疗药物获批上市,例如:(1)基于非复制型腺病毒载体用于治疗卡介苗(BCG)无响应的高风险非肌层浸润性膀胱癌(NMIBC)的 Adstiladrin;(2)用于治疗头颈部鳞状细胞癌的重组人 p53 腺病毒注射液 Gendicine,该药物由正常人肿瘤抑制基因 p53 和人工改造的重组复制缺陷型人 5 型腺病毒组成;(3)基于溶瘤腺病毒载体用于治疗头颈部肿瘤、肝癌、胰腺癌、宫颈癌等多种癌症的 Oncorine【6】。
目前,腺病毒作为溶瘤病毒载体在癌症治疗方面研究与应用较多,但由于腺病毒载体不能将目的基因整合进宿主基因组,且又不能像重组 AAV 病毒载体基因组那样以附加体的形式存在【1】,因此,非复制型腺病毒载体搭载的目的基因在目标细胞内只能获得短暂的瞬时表达,因此,在大部分单基因遗传病基因治疗方面应用较少。此外,腺病毒载体的免疫原性较强,导致其在临床使用时剂量受限。
3慢病毒载体(LV Vectors)
慢病毒载体最初来源于人类免疫缺陷病毒(HIV)【14】,其属于逆转录病毒科,慢病毒属,是一种有包膜的 RNA 病毒。第一代慢病毒载体为双质粒系统,保留了野生型 HIV 的大部分组件,虽是复制缺陷型病毒,但产生复制能力的 HIV 病毒的可能性相对较高;第二代慢病毒载体改为三质粒系统,降低了病毒的意外重组率,提高了安全性,并且原来 HIV-1 的包膜蛋白被替换成其他包膜蛋白,如来自水泡性口炎病毒的糖蛋白(VSV-G),以扩大慢病毒的感染范围。随后的几代慢病毒载体都采用了连续的优化改进,以提高其滴度和安全性。第三代慢病毒载体则去除了更多不必要的病毒序列,如辅助蛋白 vif、vpr、vpu 和 nef 等,使得病毒 RNA 不能有效转录,故意外重组的概率更低;第四代慢病毒载体则升级为四质粒系统,同时去除了 tat 序列,故意外重组而产生复制型病毒的概率进一步降低,安全性进一步提升。【15, 16】
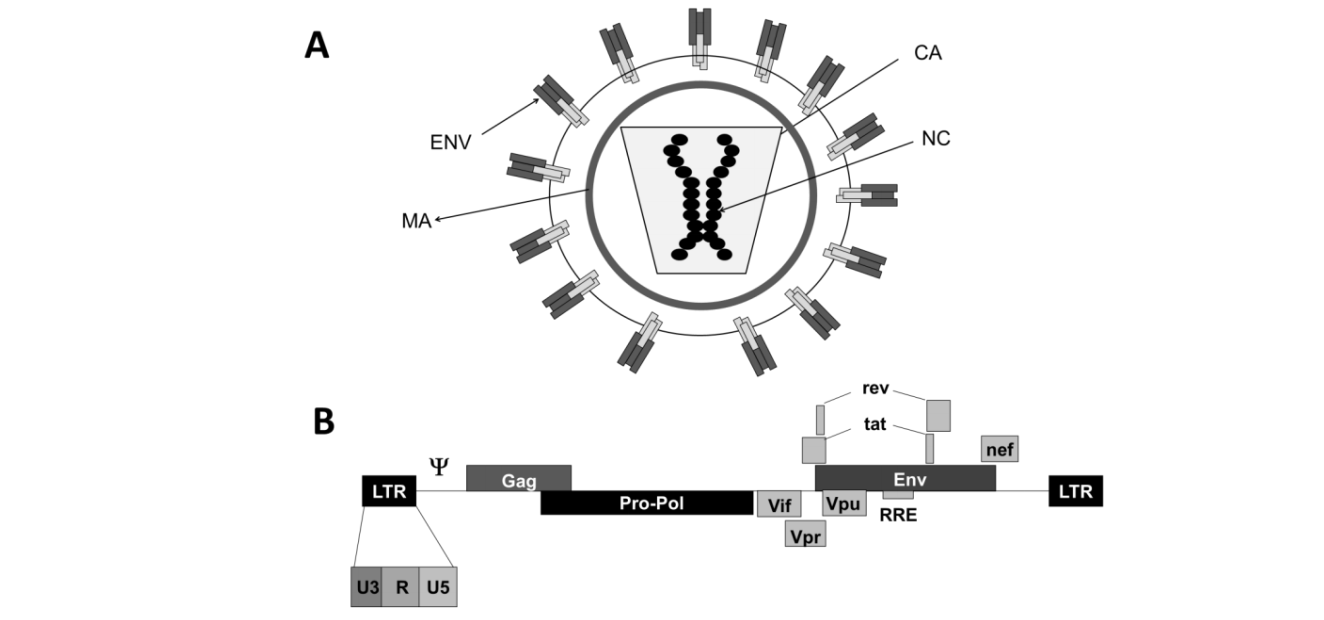
慢病毒作为基因载体,具备转导分裂和非分裂细胞的能力,能够对原代细胞和细胞系进行高效率的基因转导,可包装转导高达 11kb 的转基因并能够有效整合进入细胞基因组【18】。由于具有广泛的感染范围和高效的转导率,慢病毒在科研领域已成为常用的基因递送工具载体。在细胞基因治疗临床应用方面,慢病毒载体已成为体外细胞基因疗法主要载体之一,其针对的适应症目前主要包括单基因遗传病和癌症。目前在美国、中国、欧盟和加拿大,有上百个基因治疗临床试验项目正在使用慢病毒载体对细胞进行体外基因修饰【18】。其中,CAR-T 药物已成为慢病毒相关基因治疗药物的代表,已经有多款 CAR-T 药物在全球和中国陆续获批上市。此外,也已有多款非 CAR-T 类体外基因疗法采用慢病毒作为载体的获批上市,例如治疗脑肾上腺脑白质营养不良的 Skysona、治疗 β-地中海贫血的 Zynteglo 和治疗异染性脑白质营养不良的 Libmeldy 等【6】。
值得一提的是,由于慢病毒载体整合基因的随机性,其存在潜在的致瘤性,此外,慢病毒载体的组织器官靶向性差,因此,目前慢病毒很少用于体内基因疗法。
总之,不同的病毒在基因治疗临床应用上存在不同的优势与缺点,在选择合适的载体时需要考虑多种因素,包括感染细胞的类型、载体的基因装载能力、安全性、转基因持续表达时长、载体的免疫原性等。

